脱離反応 – コアコンセプト
このチュートリアルでは、有機化学における反応の一種である脱離反応について紹介します。 .具体的には、除去反応の 1 種類である E1 について学びます。 、メカニズムと問題の例を説明します。
他の記事で取り上げるトピック
- 求電子剤
- 求核剤
- Sn1置換反応
- Sn2 置換反応
語彙
- アルケン – 二重 (パイ) 結合
- カルボカチオン – 正電荷を帯びた炭素イオンを含む分子
- 脱プロトン – 分子からプロトン (H イオン) を除去する行為
- 中級 – 形成され、反応中に使用される化合物
- イオン化 – 電子の除去または付加によって分子が正または負の電荷を得るプロセス
- 出発 グループ – 分子から離脱できる原子またはグループ
- メカニズム – 電子と分子の動きを矢印で示す反応の視覚的プロセス
脱離反応とは?
脱離反応は、隣接する炭素から 2 つの単結合を除去することによる C-C 二重結合の形成で構成されます。炭素に結合した脱離基と隣接する炭素に結合した水素は、通常、これらのタイプの反応で切断される 2 つの結合です。
脱離反応には E1 と E2 の 2 種類があり、ステップ数が異なります。以下で E1 の排除について説明します。
最初は戸惑うかもしれませんが、反応に関連付けられている数字はステップ数ではなく、反応速度に対応していることに注意してください。 E1 は一次単分子反応です。つまり、速度は分子の濃度のみに依存します。
E1 メカニズム
E1 脱離反応には、カルボカチオン中間体が関与する 2 段階のメカニズムがあります:

最初のステップはイオン化ステップで、脱離基が分子から離れ、正のカルボカチオン中間体が残ります。脱離基は、単結合を形成するために炭素と共有していた電子を含め、完全なオクテットの電子を受け取ります。この電子の移動は、結合から X を指す矢印によって示されます。
2 番目のステップは、求核試薬またはルイス塩基による隣接炭素の脱プロトン化です。塩基は、その価電子を使用して水素をつかみます。これは、B から水素に向かう矢印で示されています。 C-H 結合から炭素間の空間を指している矢印は、この炭素が現在持っている余分な電子が、その隣の正に帯電した炭素と共有され、中性のアルケン生成物を生成することを示しています。
アルケン選択性
メカニズムの 2 番目のステップでは、隣接する炭素から水素が取り出され、二重結合が形成されます。しかし、水素を含む複数の隣接する炭素がある場合はどうなるでしょうか?どちらを選びますか?
E1 除去は、最も置換されたアルケン製品を優先します。二重結合から分岐する結合は 4 つあります。それらが水素以外の分子を含む場合、それらは置換度に関与します。アルケンの最も安定した配置は、最も置換されている配置です。
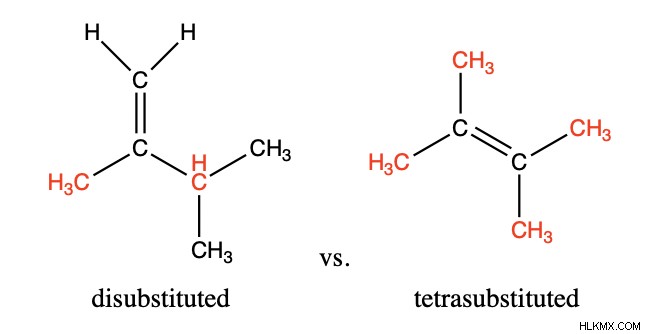
たとえば、E1 除去反応の 2 つの可能な生成物を次に示します。四置換アルケンは、二置換オプションよりも主要な生成物である可能性が高くなります.
E1排除の例
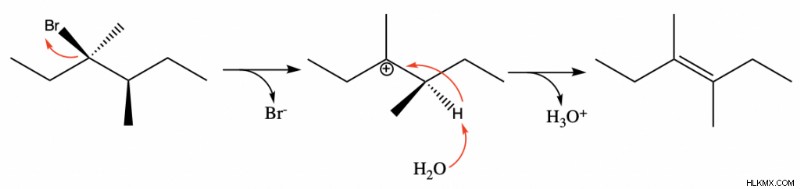
これは、E1脱離を受ける炭化水素鎖の例です。最初のステップであるイオン化は、臭素脱離基が分子から離れ、炭素に正電荷が残るときに発生します。次に、求核試薬 (この場合は水) が隣接する炭素から水素を取り込み、一時的に負電荷を生成します。水がつかむことができる複数の水素がありましたが、最も置換されたアルケン生成物が常に好まれることに注意してください.その後、電子は炭素間で共有され、中性の最終生成物が作成されます。
消去反応 – 参考文献
- E2消去反応
- E1 対 E2
- 椅子の構造
- アルカン
- シクロアルカン
- カーボン
- 立体障害
- 凝縮反応