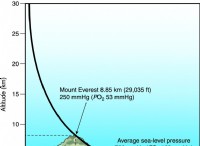
その理由は次のとおりです。
* 電気陰性 化学結合で電子を自分自身に引き付ける原子の能力の尺度です。
* 極性共有結合 2つの原子間で電気陰性度に有意な差がある場合に発生します。この違いにより、電子が不均等に共有され、一方の原子に部分的な正電荷と他の原子に部分的な負電荷が生じます。
例:
*水中の酸素(電気陰性度が高い)と水素(低電気陰性度)の結合(H₂O)は、極性結合結合です。酸素原子は共有電子をそれ自体に近づけ、わずかに陰性になりますが、水素原子はわずかに陽性になります。
対照的に:
* 非極性共有結合 2つの原子間の電気陰性度の差が非常に小さいまたはゼロの場合に発生します。電子は均等に共有されます。
* イオン結合 フォームは、大きな電気陰性度の違いがある場合、1つの原子が本質的に他の原子に電子を放棄し、完全な正と完全な負電荷を生成します。
したがって、電気陰性度は個々の原子の特性ですが、タイプに直接影響します それらの間に形成された結合のうち、極性の共有結合が最も高い電気陰性の違いを示します。