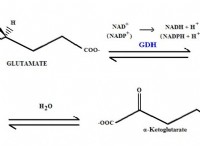
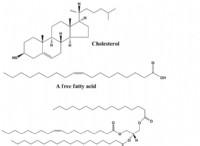
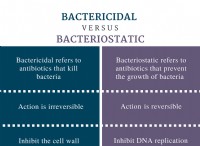
* 濃度の問題: pHは、溶液中の水素イオン(H+)の濃度の尺度です。 NaOHの50%溶液は、NaOHの重量と溶液の総重量に応じて異なるものを意味する可能性があります。 50%の重量/重量(w/w)溶液は、50%の重量/体積(w/v)溶液とは大きく異なります。
* naohは強力な基盤です: 水酸化ナトリウムは水中で完全に解離します。つまり、水酸化物イオン(OH-)をすべて放出します。 NaOHの濃度が高いほど、OH-の濃度が高くなり、溶液はより基本的な(より高いpH)になります。
pHを計算するには、次のことを知る必要があります。
1。 NaOHの正確な濃度: これは、臼歯(溶液あたりのNaOHのモル)、重量/体重の割合(溶液100グラムあたりのNaOHのグラム)、または重量/体積パーセンテージ(溶液100 mlあたりのNaOHのグラム)として表現できます。
2。温度: pHは温度に依存します。
PH:の計算にアプローチする方法は次のとおりです
1。濃度を変換: 濃度がモル濃度でない場合は、NaOHのモル質量(40 g/mol)を使用してモル濃度に変換します。
2。 poh:を計算します POHは、次の方程式による水酸化物イオン(OH-)の濃度に関連しています:POH =-LOG [OH-]
3。 ph:を計算します phとpohは次の方程式によって関連しています:ph + poh =14
例:
NaOHの50%(w/w)溶液があるとしましょう。これは、50グラムのNaOHが100グラムの溶液に存在することを意味します。
1。モル濃度の計算:
-molarity =(naoh / luters of Solutionのモル)
-NaOHのモル=50 g / 40 g / mol =1.25 mol
- 溶液の密度が1 g/mlに近いと仮定すると、100 gの溶液が約100 mL、または0.1 Lです。
-molarity =1.25 mol / 0.1 L =12.5 m
2。 poh:を計算します
-POH =-LOG [OH-] =-LOG(12.5)=-1.1
3。 ph:を計算します
-PH + POH =14
-ph =14-(-1.1)=15.1
重要な注意: pH 15.1の溶液は非常に基本的で腐食性です。 濃縮されたNAOHの取り扱いには、慎重な安全上の注意事項が必要です。
特定の安全ガイドラインと濃縮基地を処理するための適切な手順については、常に信頼できるソースを参照してください。