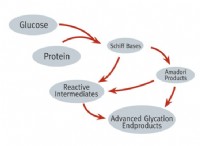
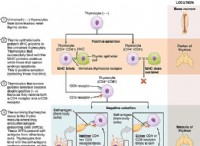
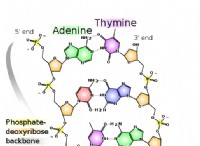
* pHおよび酸性度: pHは、溶液中の水素イオン(H+)濃度の尺度です。 pHが低いと、H+濃度が高いことが示され、溶液がより酸性になります。
* 希釈: 希釈には、溶液に溶媒(水)を追加することが含まれます。これにより、溶液中の溶質(酸)の濃度が減少します。
* H+:の濃度の低下 酸はより大きな体積に広がっているため、H+イオンの濃度が減少します。
* pHの増加: H+濃度が減少すると、pH値が増加し、より中立値に向かって移動します(7)。
例:
濃縮溶液に塩酸(HCL)のような強酸があると想像してください。このソリューションには低いpHがあります(例:1)。この溶液を水で希釈すると、HClの濃度が減少し、その結果、H+イオンの濃度が減少します。これにより、pHが高くなります(例:3)。
重要な注意: 希釈は一般にpH増加しますが、強酸は希釈後も強酸が残っていることを覚えておくことが重要です。たとえpHが高い場合でも、それらはまだかなりの数のH+イオンを持っています。