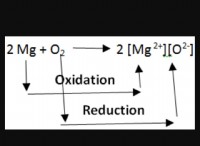
これが故障です:
* 溶質: 溶解する物質。
* 溶媒: 溶解する物質。
* ほくろ: 6.022 x 10^23粒子(原子、分子、イオンなど)に等しい、物質の量の測定単位。
なぜmolalityを使用しますか?
特定の状況では、モルリアリティは、 *溶液 *のリットルあたりの溶質のモル(溶質のモル)よりも好まれます。
* 温度独立性: 溶液の体積が拡大または契約するにつれて変化する臼歯とは異なり、モルリアルは温度変化の影響を受けません。
* 衝突特性: Molalityは、溶質粒子の濃度に依存する溶液の特性である衝突特性を計算するために使用されます。例には、凍結点のうつ病と沸点の上昇が含まれます。
Molalityの計算:
溶液のモルリティを計算するには、次のことを知る必要があります。
* 溶質のほくろ: これは、溶質の質量をそのモル質量で割ることによって見つけることができます。
* キログラムの溶媒の質量: これは通常、問題に直接与えられますが、溶液の総質量から溶質の質量を差し引くことで計算することもできます。
例:
1 kgの水に溶解した0.5モルのNaClを含む溶液があるとしましょう。 このソリューションのモルリリティは次のとおりです。
Molality(M)=0.5モルNaCl/1 kg水=0.5 mol/kg
要約すると、Molalityは温度変動とは無関係で、ソリューションの衝突特性を理解するために重要な濃度の信頼できる尺度を提供します。