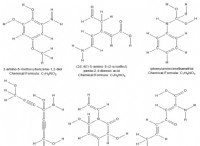
ここに理由があります:
* 誘導効果: 塩素は、炭素や水素よりも電気陰です。これは、塩素原子が電子密度を引き出していることを意味します。この電子吸引効果は、誘導効果と呼ばれます。
* コンジュゲートベースの安定化: カルボン酸がプロトン(H+)を失うと、カルボン酸アニオン(RCOO-)を形成します。コンジュゲートベースが安定しているほど、酸が強くなります。
* トリクロロ酢酸: トリクロロ酢酸では、3つの塩素原子がカルボン酸アニオンに強い誘導効果を発揮し、電子密度を引き出し、負電荷を安定化します。これにより、コンジュゲートベースがより安定し、酸が強くなります。
* ジクロロ酢酸: ジクロロ酢酸には2つの塩素原子があり、トリクロロ酢酸と比較して誘導効果が低下します。これにより、安定したコンジュゲートベースと弱い酸が生じます。
* モノクロロ酢酸: モノクロロ酢酸には塩素原子が1つしかないため、3つの間で最も弱い誘導効果が生じます。したがって、その共役塩塩塩は最も安定性が低く、最も弱い酸になります。
要約: 酢酸分子に存在する塩素原子が多いほど、誘導効果が強くなり、より安定したコンジュゲートベースとより強い酸につながります。