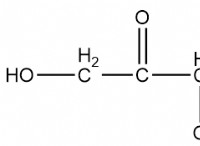
1。 濃度の正味の変化はありません: 前方および逆反応速度は等しい。これは、反応物と生成物の濃度が時間の経過とともに一定のままであることを意味します。
2。 動的平衡: 濃度に正味の変化はありませんが、反応はまだ進行中です。反応物は常に製品に変わり、製品は常に反応物に戻っています。それは、両方向に交通が均等に流れるにつれての忙しい通りのようなものです。
3。 定数k eq (平衡定数): それぞれの化学量論係数に上昇した反応物濃度に対する生成物濃度の比率は、特定の温度で一定です。この定数は、平衡定数(k eq として知られています )。
4。 可逆性: 平衡時のすべての反応は可逆的です。これは、反応が前方向と逆方向の両方で進行できることを意味します。
5。 ギブス自由エネルギーの最小化: システムは、最小ギブスの自由エネルギーの状態です。これは、システムが与えられた条件下で最も安定した状態にあることを意味します。
6。 変更への応答: 条件(温度、圧力、濃度)を変更すると、平衡がシフトして再確立します。これは、Le Chatelierの原則によって説明されています。
要約:
平衡状態での反応とは、順方向と逆反応速度が等しい状態であり、その結果、反応物と生成物の一定の濃度が生じます。この状態は動的です。つまり、反応はまだ進行中ですが、濃度の正味の変化はゼロです。平衡定数(k eq )特定の温度で一定であり、システムは最も安定した状態です(最小ギブス自由エネルギー)。