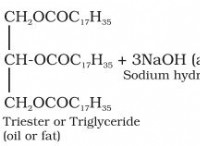kohとph の理解
* koh(水酸化カリウム): 水中で完全に解離する強力なベースは、すべての水酸化物イオン(OH-)を溶液に放出することを意味します。
* ph: 溶液の酸性度またはアルカリ度の尺度。 7のpHはニュートラルで、7未満の値は酸性であり、7を超える値は基本(アルカリ)です。
計算
1。 poh:を計算します KOHは強い塩基であるため、水酸化物イオンの濃度([OH-])はKOHの濃度に等しくなります。
* [oh-] =3.0 m
* poh =-log [oh-] =-log(3.0)≈ -0.48
2。 ph:を計算します phとpohの関係を使用します。
* ph + poh =14
* ph =14 -poh =14-(-0.48)≈14.48
結果
3.0 m KOH溶液のpHは約 14.48 です 。これは非常に高いpHであり、強くアルカリ性溶液を示しています。