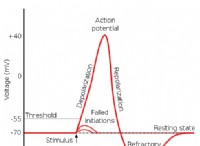
これが故障です:
* arrhenius定義: 酸は、水に溶解すると水素イオン(H+)を生成する物質です。
* brønsted-lowry定義: 酸はプロトン(H+)ドナーであると述べているより広い定義。
酸の例:
* 塩酸(HCl): 水に溶解すると、HClはH+イオンと塩化物イオン(CL-)を放出し、溶液を酸性にします。
* 硫酸(H2SO4): この強酸は、水に溶解すると、分子あたり2つのH+イオンを放出します。
* 酢酸(CH3COOH): この弱酸は酢に含まれています。溶液中のH+イオンの少量のみを放出します。
キーポイント:
* ph: 溶液の酸性度は、pHスケールを使用して測定されます。 pH値が低いと、酸性度が高いことがわかります(H+イオンの多く)。
* 酸は塩基と反応します: 酸は塩基を中和し、塩と水を形成します。
* 酸は腐食性になる可能性があります: 多くの酸は、火傷や材料の損傷を引き起こす可能性があります。
注: 水素イオンの存在は重要ですが、酸の特定の化学構造と特性は、その酸性度とその他の特性も決定します。