* 金属:
*低イオン化エネルギーを持っている 、つまり、彼らは電子を簡単に失い、正に帯電したイオン(陽イオン)を形成します。
*通常、 1つ、2つ、または3つの価電子があります (最も外側のシェルの電子)、彼らは容易にあきらめます。
* 非金属:
*高い電気陰性度を持っています 、つまり、彼らは電子を強く引き付けます。
*通常、 5、6、または7つの価電子があります そして、最も外側のシェルに安定したオクテット(8つの電子)を実現するために電子を獲得する傾向があり、負に帯電したイオン(アニオン)を形成します。
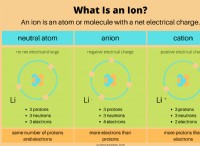
イオン結合形成:
金属と非金属が反応すると、金属原子は電子を失い、陽イオンになり、非金属原子はそれらの電子を獲得して陰イオンになります。結果として生じる反対に帯電したイオンは、静電力によって互いに引き付けられます 、強いイオン結合を形成します。
例:
塩化ナトリウム(NaCl)の形成を検討してください。
*ナトリウム(Na)は、1つの価電子を持つ金属です。この電子を容易に失い、+1カチオン(Na⁺)になります。
*塩素(Cl)は、7つの原子価電子を持つ非金属です。 1つの電子を獲得して-1アニオン(cl⁻)になります。
反対に帯電したイオン(Na⁺とcl⁻)は互いに引き付けられ、イオン結合を形成し、塩化物ナトリウムを生成します。
要約:
正に帯電した金属カチオンと負に帯電した非金属陰イオンの間の強い魅力は、イオン化合物の形成を促進します。このプロセスは、金属の電子と非金属の電子を獲得する傾向を失う傾向が促進され、安定したエネルギー的に好ましい配置につながります。