1。イオン化と導電率
* 導電率: 電気を導入する溶液の能力は、電流を動かして運ぶことができる遊離イオン(荷電粒子)の存在に依存します。
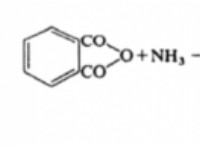
* イオン化: 酸は、水に溶解すると水素イオン(H+)を放出します。放出される水素イオンが多いほど、導電率が大きくなります。
2。強酸対弱酸
* 強酸: 溶液中の強酸イオン *ほぼ完全に *。これは、分子の高い割合がH+イオンとその共役塩基に解離することを意味します。
* 弱酸: 弱酸イオン化 *部分的にのみ *溶液中。それらは、分子のごく一部がイオン化され、残りが分子形にとどまる平衡に達します。
3。 導電率への影響
* 強酸: 強酸は高濃度の遊離H+イオンを生成するため、導電率が高くなっています。
* 弱酸: 弱酸は、イオンが限られているため、はるかに低い濃度のH+イオンを生成します。 これにより、導電率が低下します。
例:
* HCl(塩酸): ほぼ完全に水でイオン化し、多数のH+イオンとcl-イオンを生成し、高い導電率を引き起こします。
* ch3cooh(酢酸): 弱酸、その分子のごく一部のみが水でイオン化します。 H+イオンとCh3cooイオンが少なく、導電率が低下します。
要約: 重要な違いは、イオン化の程度です。強酸はより完全にイオン化し、イオンの濃度が高くなり、電気伝導率が向上します。