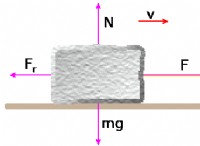
概念を理解する
* 凍結点うつ病: 溶液の凍結点は、純粋な溶媒の凍結点よりも低いです。これは凍結点うつ病と呼ばれます。
* van't Hoff Factor(i): cacl₂は、溶液中の3つのイオン(1つのCa²⁺と2つのCl⁻イオン)に分離します。 Van't Hoff因子(i)は、溶質が溶液中に生成する粒子の数を表します。 cacl₂の場合、i =3。
* 凍結点うつ病方程式: Δt f =i * k f * m
ここで:
*Δt f =凍結点の変化(°C)
* i =van't Hoff Factor
* k f =水の凍結点うつ病定数(1.86°C/m)
* M =溶液のモルリアル
計算
1。凍結点の変化を計算します(Δt f ):
Δt f =(3) *(1.86°C/m) *(2.65 m)=15.6°C
2。新しい凍結点を決定します:
純水の凍結点は0°Cです。
新しい凍結点=0°C -15.6°C =-15.6°C
したがって、塩化カルシウム溶液2.65 mの凍結点は-15.6°Cです。