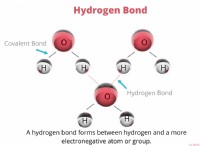
1。活性化エネルギー(EA):
*より低い活性化エネルギーとの反応はより速く進み、その製品の収量が高くなります。これは、より低い活性化エネルギーが、より多くの分子がエネルギー障壁を克服して反応するのに十分なエネルギーを持っていることを意味するためです。
2。熱力学的安定性(Δg°):
*形成の低いギブス自由エネルギー(Δg°)を備えた製品は、熱力学的により安定し、平衡状態で好まれます。これは、十分な時間を考えると、反応がより多くの熱力学的に好まれる製品の生産にシフトすることを意味します。
3。反応速度定数(k):
*各反応経路には独自の速度定数があり、これは反応物がその特定の製品に変換される速度を反映しています。速度定数が高いほど、反応が速く、その製品の収率が高くなります。
4。温度:
*温度は、2つの反応の相対速度に異なる影響を与える可能性があります。温度の上昇は一般に両方の反応の速度を増加させますが、活性化エネルギーが大幅に異なる場合、1つの反応が他の反応よりも1つの反応を好む可能性があります。
5。反応物の濃度:
*反応物の濃度は、2つの反応の相対速度に影響を与える可能性があります。場合によっては、反応物の濃度が高くなると、ある反応経路が別の反応経路を支持する場合があります。
6。触媒:
*触媒は、1つの反応経路を別の反応経路よりも選択的に加速し、特定の製品の収率が高くなる可能性があります。
7。溶媒効果:
*反応で使用される溶媒は、2つの反応の速度に異なって影響を与える可能性があり、ある産物の形成を別の産物よりも好む可能性があります。
8。 運動制御対熱力学的制御:
* 運動制御 より低い活性化エネルギーとの反応がより速く進み、より多くの製品を生成するほど十分に低い温度で反応が実行される条件を指します。
* 熱力学的制御 反応が平衡に達することが許される条件を指し、形成の低いギブス自由エネルギーを持つ製品が好まれます。
概要:
並列反応における2つの製品の相対量は、これらの要因の複雑な相互作用によって決定されます。多くの場合、2つの反応の相対速度は、製品の分布を決定する最も重要な要因です。