1。ロンドン分散部隊(LDF)
* タイプ: すべての分子に存在する最も弱い分子間力。
* 原因: 一時的な電子分布の一時的な瞬間的な変動は、一時的な双極子を生成します。
* 強さ: 分子サイズと表面積とともに増加します。
2。双極子ダイポール力
* タイプ: 極性分子間の分子間力。
* 原因: 不均一な電子共有による分子の永久双極子。
* 強さ: LDFよりも強いが、水素結合よりも弱い。
3。水素結合
* タイプ: 水素が高電気陰性の原子(O、N、またはF)に結合される特別なタイプの双極子ダイポール力。
* 原因: 部分的に陽性の水素と部分的に負の電気陰性原子の間の強い静電引力。
* 強さ: 分子間力の最も強いタイプ。
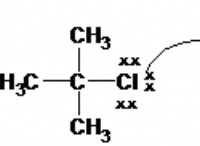
4。イオン結合
* タイプ: 分子内(分子内)反対に帯電したイオン間の力。
* 原因: 陽イオンと陰イオンの間の強い静電引力。
* 強さ: 非常に強く、通常、最も強いタイプの絆。
5。共有結合
* タイプ: 原子間の電子の共有を含む分子内(分子内)力。
* 原因: 共有電子と原子の核との間の引力。
* 強さ: 共有結合のタイプ(シングル、ダブル、トリプル)に応じて異なります。 一般にイオン結合よりも強い。
重要な注意:
*イオンおよび共有結合は分子間の力よりも強いが、強度は直接匹敵するものではない。
*共有結合の強度は大きく異なる場合があります(たとえば、トリプル結合は単一の結合よりも強いです)が、イオン結合は一般に同様の強度範囲にあると考えられています。
これ以上質問がある場合はお知らせください!