その理由は次のとおりです。
* 電子構成: 水素には1つのプロトンと1つの電子しかありません。このシンプルな構成により、金属と非金属の両方と類似点が共有されます。
* 物理的特性: 水素は、室温での無色の無臭のガスであり、非金属の典型的な特徴です。ただし、高圧下では、液体金属になる可能性があります。
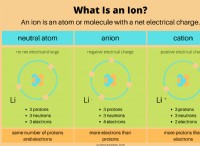
* 化学反応性: 水素は陽イオンと陰性の両方のイオンを形成できます。これは、金属と非金属の両方で共有される特性です。
* 周期表の位置: 水素はグループ1(アルカリ金属)の上部に配置されますが、その特性はアルカリ金属の特性と完全には整合していません。
要約:
水素のユニークな特性により、金属または非金属のいずれかとして明確に分類することが難しい要素になります。多くの場合、2つのカテゴリ間の「特別なケース」または「ブリッジ」と見なされます。
重要な注意: ほとんどの場合、水素は非金属として扱われます 実用的な目的のために。これは主に、室温での物理状態と非金属との一般的な結合挙動のためです。