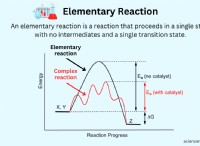
1。二酸化炭素の吸収(CO2):
* 基本的なソリューション: 空気からのCO2は水に溶けて炭酸(H2CO3)を形成します。この酸は、基本溶液に存在する水酸化物イオン(OH-)と反応し、塩基の一部を中和します。このプロセスは、次の均衡で表されます。
* CO2(g) + H2O(L)⇌H2CO3(aq)⇌H +(aq) + hco3-(aq)
* h +(aq) + oh-(aq)⇌h2o(l)
* 酸性溶液: CO2は水と反応する可能性がありますが、通常、強酸の濃度への影響は無視できます。これは、強酸が陽子(H+)を容易に供与し、HCO3の形成に効果的に平衡を押し進め、H2CO3の有意な形成を防ぐためです。
2。水の蒸発:
* 酸性溶液と基本的なソリューション: 水は、空気にさらされると溶液から蒸発し、より濃縮された溶液を残します。このプロセスはソリューションを直接中和するものではありませんが、酸または塩基の濃度を増加させ、より強く見せます。
3。ほこりまたは空中粒子との反応:
* 酸性溶液と基本的なソリューション: 空気中の粉塵、汚染物質、または他の粒子の存在は、溶液中の酸または塩基と反応し、濃度の変化を引き起こす可能性があります。
したがって、「中和された」という用語は完全に正確ではないかもしれませんが、肥満に残っている水性酸または塩基性溶液はその濃度の変化を起こす可能性があり、しばしばその強度の低下につながります。