電子構成の理解:
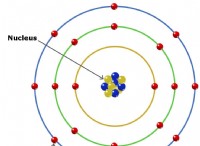
* 2-1: これは、最も外側のシェル(価数シェル)に1つの電子を持つ原子を表します。この原子は、リチウム(LI)のようなグループ1要素である可能性があります。
* 2-7: これは、最も外側のシェルに7つの電子を持つ原子を表します。この原子は、フッ素(F)のようなグループ17要素である可能性があります。
結合形成:
* 電気陰性度: グループ1要素は電気陰性度が低いため、電子の魅力が弱いことを意味します。グループ17の元素は、電気陰性度が高いことを意味します。つまり、電子に強い魅力があります。
* イオン結合: 2つの原子間の電気陰性度の大きな違いは、イオン結合につながります 。電気陰性度が低い(2-1)の原子は、より高い電気陰性度(2-7)で原子に対してその価電子を失います。これにより、積極的に帯電したイオン(陽イオン)と負の帯電イオン(アニオン)が形成され、静電引力によって一緒に保持されます。
例:
リチウム(Li、2-1)がフッ素(F、2-7)と反応すると、リチウムはその原子価電子を失い、li陽イオンになります。フッ素は電子を獲得してf⁻アニオンになります。得られた化合物は、イオン結合によって一緒に保持されているフッ化リチウム(LIF)です。
要約: 2-1と2-7の基底状態の電子構成を持つ原子の間に形成される結合は、主にイオンです 。