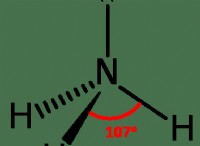
しばしばオクテットルールに違反する原子
* 水素(H): 水素には 2つの電子のみが必要です 安定した構成を実現するための最も外側のシェル。
* リチウム(li)、ベリリウム(be)、ホウ素(b): これらの要素は、オクテットを達成するには電子が少なすぎます。多くの場合、周囲の8つの電子が少ない化合物を形成します。
* 期間3以降の要素: 期間3(ナトリウム、硫黄など)から始めて、要素はd軌道にアクセスできます。これにより、外側のシェルに8つ以上の電子を収容できます。いくつかの一般的な例:
* リン(P): 外側のシェルに10個の電子を持つことができます(例:PF5)
* 硫黄: 外側のシェルに12個の電子を持つことができます(例:SF6)
* 塩素(cl): 外側のシェルに14個の電子を持つことができます(たとえば、CLF3)
Octetルールに違反した理由
* 電子欠乏: 外側のシェルに電子が少なすぎる要素は、常にオクテットに到達することはできません。
* 価数シェルの拡張: 期間3以降の要素には、オクテットを超えて価電子シェルの拡張を可能にするD軌道があります。
* 電子の奇数数: フリーラジカル(奇数の電子を持つ分子)は、すべての原子のオクテットルールを満たすことができません。
例
* bf3(トリフッ化ホウ素): ホウ素には3つの原子価電子しかなく、外殻に6つの電子が残っています。
* sf6(硫黄ヘキサフルオリド): 硫黄にはその周りに12個の電子があり、オクテットを超えています。
* no2(二酸化窒素): 二酸化窒素は、奇数の電子を持つフリーラジカルであり、すべての原子がオクテットを持つことは不可能です。
重要な注意: Octetルールは、絆を理解するための有用なガイドラインですが、それは絶対的なルールではありません。多くの例外があり、これらの例外の理由を理解することは、化学結合を完全に理解するために重要です。