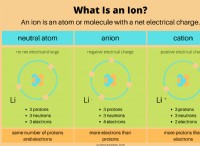
1。各原子の電子の数を決定します:
* 窒素(n): 窒素の原子数は7です。つまり、中性原子に7つのプロトンと7つの電子があります。
* 水素(H): 水素の原子数は1つです。つまり、中性原子に1陽極と1つの電子があります。
2。 nh₄:の電子の総数を計算します
* 窒素: 7つの電子
* 水素(x4): 1電子/原子 * 4原子=4電子
* 合計: 7 + 4 =11電子
3。正電荷を説明します:
アンモニウムイオン(nh₄⁺)には+1電荷があります。これは、1つの電子を失ったことを意味します。
4。最終計算:
11電子(中性nh₄)-1電子(正電荷により失われる)= 10電子
したがって、nh₄⁺イオンには10個の電子があります。