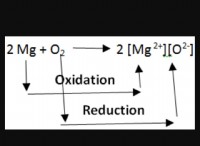
基本的な反応
炭素は、電子を容易に失うため、良好な還元剤です。炭素が金属酸化物と反応すると、金属酸化物から酸素を除去し、純粋な金属を残します。 一般的な反応は次のように表現できます。
`` `
金属酸化物 +炭素→金属 +二酸化炭素
`` `
例:鉄鉱石(fe₂o₃)
鉄の主要な供給源である鉄鉱石(Fe₂O₃)の例を使用しましょう。
`` `
fe₂o₃ + 3c→2fe + 3co
`` `
電子移動の内訳
1。炭素の役割: 炭素原子は、電子を失い、正電荷を形成する強い傾向があります。この反応では、炭素は還元剤として機能します 、電子を金属酸化物に寄付します。
2。金属酸化物の役割: 金属酸化物は通常、イオン化合物です。つまり、金属イオン(正に帯電した)および酸素イオン(負に帯電した)が含まれています。酸化物中の酸素イオンは、中性酸素原子になるために電子を獲得する必要があります。
3。転送:
*炭素原子は電子を失い、積極的に帯電した炭素イオンになります。
*これらの電子は、金属酸化物の酸素イオンに伝達されます。
*酸素イオンは電子を獲得し、中性酸素原子になります。
4。二酸化炭素の形成: 酸素原子は炭素イオンと結合し、二酸化炭素(CO₂)を形成します。
一番下の行
還元プロセスは、本質的に炭素から酸化金属の酸素への電子の伝達です。この電子の伝達は、金属酸化物の結合を破壊し、その元素の形で金属を解放します。
重要な注意: この反応は通常、電子伝達に必要なエネルギーを提供するために、高温で(たとえば爆風炉で)発生します。