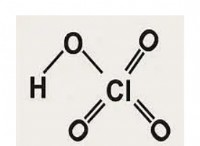
固体フォーム:
* 固定イオン: 固体イオン化合物では、イオンは剛体格子構造に閉じ込められています。 それらは強い静電力によって所定の位置に保持されています。
* 無料電荷キャリアなし: イオンはしっかりと結合されており、自由に動くことはできません。これは、電流を運ぶために利用できる荷電粒子がないことを意味します。
* 絶縁体: その結果、固体イオン化合物は一般に良好な絶縁体であり、電気の流れに抵抗することを意味します。
溶解または液体形式:
* モビリティ: イオン化合物が溶媒(水など)に溶解するか、溶融すると、イオンは固定位置から解放されます。それらはモバイルになり、溶液内を動き回ったり溶けたりすることができます。
* 電荷キャリア: これらのモバイルイオンは電荷キャリアとして機能します。電位(電圧)が適用されると、正の帯電イオンは負の電極(カソード)に向かって移動し、負に帯電したイオンは正の電極(アノード)に向かって移動します。
* 導電率: イオンのこの動きは電流を作成し、溶液を作るか、電気導体を溶かします。
要約:
重要な違いは、イオンの可動性にあります。固体形態では、イオンは固定されており、電荷を運ぶことができません。溶解または液体の形では、イオンは自由に移動でき、電荷を輸送できるようになります。
例:
* 固体NaCl(テーブルソルト): 電気は行われません
* 水に溶解したNaCl: Na+およびCl-イオンは溶液中に自由に移動できるため、電気を導入します。
* Molten naCl: イオンは液体状態で自由に移動できるため、電気を導入します。