水素ガス分子内の 2 つの水素原子を結合する結合は、古典的な共有結合です。結合は、水素原子がそれぞれ 1 つの陽子と 1 つの電子しか持たないため、分析が容易です。電子は水素原子の単一電子殻にあり、そこには 2 つの電子のためのスペースがあります。
水素原子は同一であるため、どちらも他方から電子を受け取って電子殻を完成させ、イオン結合を形成することはできません。その結果、2 つの水素原子は共有結合で 2 つの電子を共有します。電子はほとんどの時間を正電荷を帯びた水素原子核の間で過ごし、2 つの電子の負電荷に引き寄せられます。
TL;DR (長すぎる; 読んでいない)
水素ガスの分子は、共有結合の 2 つの水素原子で構成されています。水素原子は、酸素原子を含む水や炭素原子を含む炭化水素など、他の化合物でも共有結合を形成します。水の場合、共有結合した水素原子は、共有分子結合よりも弱い追加の分子間水素結合を形成できます。これらの結合は、水にその物理的特徴の一部を与えます。
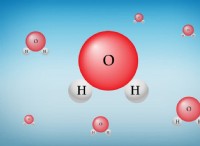
水中の共有結合
H2 の水素原子 O水分子は、水素ガスと同じ種類の共有結合を形成しますが、酸素原子と結合しています。酸素原子の最も外側の電子殻には 6 個の電子があり、そこには 8 個の電子が入るスペースがあります。その殻を満たすために、酸素原子は共有結合で 2 つの水素原子の 2 つの電子を共有します。
共有結合に加えて、水分子は他の水分子と追加の分子間結合を形成します。水分子は極性双極子です。つまり、分子の一方の端である酸素端は負に帯電し、2 つの水素原子を含むもう一方の端は正に帯電します。 1 つの分子の負に帯電した酸素原子は、別の分子の正に帯電した水素原子の 1 つを引き付け、双極子間水素結合を形成します。この結合は共有分子結合よりも弱いですが、水分子を一緒に保持します。これらの分子間力は、分子の重量に対して高い表面張力や比較的高い沸点など、水に固有の特性を与えます。
炭素と水素の共有結合
炭素の最も外側の電子殻には 4 つの電子があり、そこには 8 つの電子が入るスペースがあります。その結果、1 つの構成では、炭素は 4 つの水素原子と 4 つの電子を共有して、共有結合でそのシェルを埋めます。得られた化合物はCH4 、メタン。
4 つの共有結合を持つメタンは安定な化合物ですが、炭素は水素や他の炭素原子と他の結合配置に入ることができます。外側の 4 つの電子配置により、炭素は多くの複雑な化合物の基礎を形成する分子を作成できます。このような結合はすべて共有結合ですが、結合挙動において炭素に大きな柔軟性を与えます。
炭素鎖の共有結合
炭素原子が 4 個未満の水素原子と共有結合を形成すると、余分な結合電子が炭素原子の外殻に残ります。たとえば、3 つの水素原子と共有結合を形成する 2 つの炭素原子は、それぞれが互いに共有結合を形成し、残りの 1 つの結合電子を共有することができます。その化合物はエタン、C2 H6 .
同様に、2 つの炭素原子はそれぞれ 2 つの水素原子と結合し、互いに二重共有結合を形成して、残りの 4 つの電子を共有します。その化合物はエチレン、C2 H4 .アセチレンでは、C2 H2 、2つの炭素原子は三重共有結合を形成し、2つの水素原子のそれぞれと単結合を形成します。これらの場合、関与する炭素原子は 2 つだけですが、2 つの炭素原子は互いに単結合のみを容易に維持し、残りを使用して追加の炭素原子と結合することができます。
プロパン、C3 H8 、それらの間に一重共有結合を持つ3つの炭素原子の鎖があります。両端の炭素原子には、中央の炭素原子との単結合と、それぞれ 3 つの水素原子との 3 つの共有結合があります。中央の炭素原子は、他の 2 つの炭素原子および 2 つの水素原子と結合しています。このような鎖ははるかに長くなる可能性があり、自然界に見られる複雑な有機炭素化合物の多くの基礎となっています。これらはすべて、2 つの水素原子を結合する同じ種類の共有結合に基づいています。