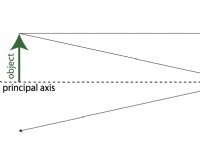
コア コンセプト
このチュートリアルでは、 pKa について学びます。 Ka および pH との関係と、Ka および pH から pKa を計算する方法。
他の記事で取り上げるトピック
- 酸塩基化学
- 強酸と強塩基
- 化学反応の種類
- 酸と塩基の性質
語彙
ブレンステッド酸 – プロトン (H) を別の分子に供与できる任意の種。
pKaとは?
簡単に言えば、pKa は酸の強弱を表す数値です。強酸の pKa はゼロ未満です。より正確には、pKa は Ka 値 (酸解離定数) の 10 を底とする負の対数です。酸の強さ、つまりブロンステッド酸がプロトンをどれだけしっかりと保持しているかを測定します。 pKa の値が低いほど、酸が強くなり、陽子を供与する能力が高くなります。
pKa と Ka
Ka は酸解離定数を表します。酸が水溶液中でどの程度完全に解離するかを測定します。 Ka の値が大きいほど、酸は大きく解離してイオンになります。
Ka から pKa へ
pKa と Ka の関係は、次の式で表されます:
pKa =-log[Ka]
pKa から Ka へ
逆に、pKa が与えられている場合、Ka は測定可能です:
カ=10
pKa と pH
pH は、水溶液中の水素イオンの濃度の尺度です。 pH値が低いほど、溶液中の水素イオン濃度が高くなります。したがって、酸が強くなります。
pKa は分子が特定の pH で何をするかを予測するのに役立つため、pKa と pH は関連しています。基本的に、pKa は、化学種がプロトンを供与または受容できるために必要な pH を明らかにします。
pKa と pH の関係は、Henderson-Hasselbalch の式で表されます:
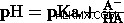
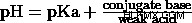
一部の弱酸および強酸の pKa:
青酸 pKa =9.21 (HCN、弱酸):
酢酸 pKa =4.75 (弱酸)
フッ化水素酸 pKa =3.14 (HF、弱酸)
塩酸 pKa =-8 (HCl、強酸):
硫酸pKa~3(強酸)
いくつかの pKa がここにあります。
お気に入りの化学実験
このビデオでは、酸、ベース、または pKA は使用されていません。非常にクールなケミストリーだけです!