コアコンセプト:
このチュートリアルでは、周期表の読み方を学びます。周期表のグループを詳しく見ていきます。さらに、周期表のグループ、周期、族のさまざまな特性について学習します。この記事が気に入ったら、ぜひ他の記事もチェックしてください!
関連記事:
- 定期的なトレンドを簡単に
- 要素
- 電子殻構成の書き方
- 原子半径の傾向
- イオン化エネルギーの傾向
- 元素名の周期表
語彙
- 元素:固有の原子番号を持つ単一の原子で構成される純粋な物質。
- グループ:元素の価電子の数を表す周期表の縦列。
- 周期:元素の電子殻の数を表す、周期表の横の行。
- ファミリー:価電子の数が同じで、特性が似ている元素。
トレンド、家族、グループをインタラクティブに表示!
私たちの周期表は世界で最高のものの 1 つだと思います!新しいインタラクティブな周期表をご覧ください。あらゆる種類の傾向、特性、磁性、電子、さらにはすべての要素に関する記事を表示できます!
周期表と周期トレンド
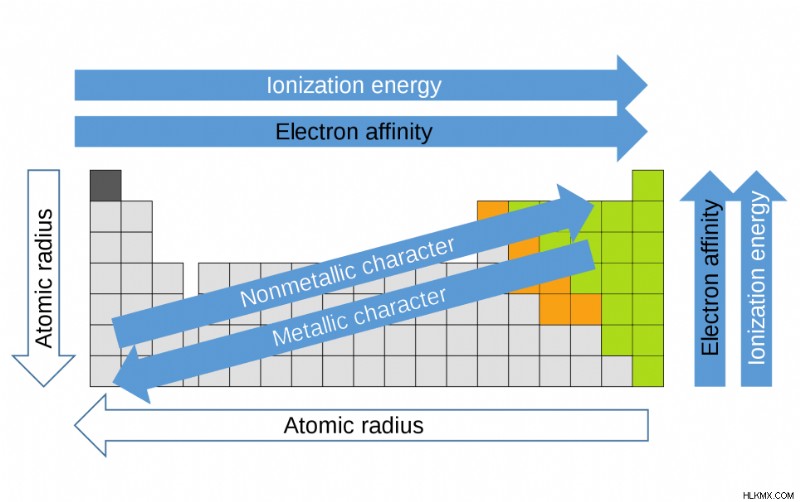
周期表は、グループ (縦の列)、周期 (横の行)、およびファミリー (類似した元素のグループ) に編成されています。同じグループの要素 同じ数の価電子を持っています。一方、同じ期間の要素 同じ数の占有電子殻を持っています。 1869 年、ロシアの化学者ドミトリー・メンデレーエフは、化学元素の組織化に生来のパターンが存在することに気付きました。この演繹から、彼は周期表を形成しました。このテーブル上の要素の位置が、それらのプロパティをどのように示しているかに注意することが重要です。元素の化学的および物理的特性を理解する簡単な方法は、周期的な傾向を知ることです。これらの傾向は、周期表のどこに最も高いタイプと最も低いタイプのプロパティが集中しているかを示しています。定期的な傾向の詳細については、ここをクリックしてください。
グループと期間
グループは周期表の列であり、期間は行です。 18 のグループがあり、ランタニドとアクチニドを加えた 7 つのピリオドがあります。
周期表の周期
では、周期表の周期とは何ですか? 期間 周期表の水平方向の行です。全部で 7 つの周期があり、周期内の各要素には同じ数の原子軌道があります。水素とヘリウムを含む一番上のピリオドには、軌道が 2 つしかありません。行を下るにつれて、軌道の数が増えます。以下は、周期数と対応する軌道を視覚化するのに役立つ表です。
| 期間番号 | 軌道の数 | 要素数 |
| 1 | 1 | 2 |
| 2 | 2 | 8 |
| 3 | 3 | 8 |
| 4 | 4 | 18 |
| 5 | 5 | 18 |
| 6 | 6 | 32 |
| 7 | 7 | 32 |
周期表のグループ
前述したように、周期表の縦の列は「グループ」と呼ばれます。周期表には全部で 18 のグループがあり、各 周期表グループ 同じ数の価電子を持つ元素が含まれています。
存在する価電子の数は、元素の特性を決定します。その理由は、最外殻の電子である価電子が化学反応に参加するものだからです。これらの電子は、寄付、受け取り、または共有のいずれかです。さらに、原子価殻が満たされているほど、元素はより安定しています。
周期表にはいくつのグループがありますか?
周期表には、周期表の各列に 1 つずつ、合計 18 のグループがあります。左側の最初の列はグループ 1 で、右側の最後の列はグループ 18 です。
基と価電子
最初のグループは、価電子が 1 つしかないため、最も安定性が低くなります。一方、グループ 18 は、これらの元素が完全な原子価殻 (8 個の価電子) を持っているため、最も安定しています。以下は、基数と価電子数を関連付けた表です。
| グループ番号 | 価電子の数 |
| 1 | 1 |
| 2 | 2 |
| 3-12 | 2 |
| 13 | 3 |
| 14 | 4 |
| 15 | 5 |
| 16 | 6 |
| 17 | 7 |
| 18 | 8 |
周期表の族
周期表には家族があります これは、類似した特性を持つ要素のグループです。これらの族は、アルカリ金属、アルカリ土類金属、遷移金属、遷移後金属、半金属、ハロゲン、貴金属、および希ガスです。これらの族の多くは、周期表の単一のグループに属しています。ただし、すべてのファミリが周期表グループと重複するわけではありません。たとえば、遷移金属には、3 族から 12 族までのすべての元素が含まれています。以下は、各ファミリーの位置を表示する周期表です。
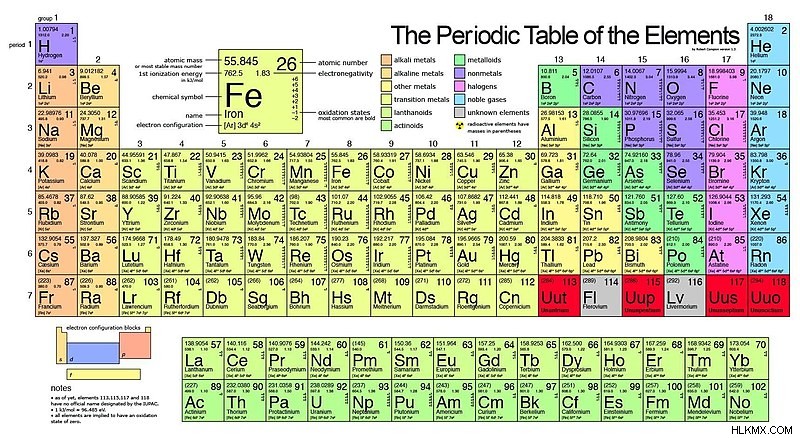
アルカリ金属 (グループ 1)
アルカリ金属は、水素を除くグループ 1 のすべての元素で構成されています。これらの元素は非常に反応性が高いため、通常は化合物に含まれています。さらに、水に弱い (水と激しく反応する) ため、油中に保管する必要があります。最も反応性の高いアルカリ金属はフランシウムで、グループが上がるにつれて減少します。これは、リチウムが最も反応性が低いことを意味します。物理的には、アルカリ金属ファミリーは銀色で、白く、軽いです。また、低融点、低沸点です。
アルカリ土類金属 (グループ 2)
アルカリ土類金属は、周期表で 2 番目に反応性の高い族です (アルカリ金属に次いで)。さらに、それらは強力な還元剤であるため、化学反応で電子を供与します。また、優れた熱伝導体および電気伝導体でもあります。物理的には、低密度、低融点、低沸点です。
希土類金属:ランタノイド
ランタニドは、5d シェルに 1 つの価電子を含む希土類金属のファミリーです。それらは反応性が高く、反応における強力な還元剤です。さらに、それらは銀色に輝く金属であり、比較的柔らかいです。また、高融点と高沸点の両方を持っています。レアアースには、ネオジムやエルビウムなどの元素が含まれています。
希土類金属:アクチノイド
アクチニドは、希土類金属の別のファミリーです。ランタニドと同様に、これらの元素は非常に反応性があります。それらはまた、高い電気陽性率を持ち、放射性です。さらに、これらの元素には、常磁性、自然放火性、および同素体の特性が含まれています。物理的には、ランタニドに非常に似ています。それらは柔らかく、展性があり、延性がある銀色の金属です。
遷移金属 (グループ 3-11)
遷移金属は通常、2 つ以上の酸化状態を形成します。イオン化エネルギーが低く、導電率が高い。さらに、それらは高融点、高沸点、および高導電性を備えています。物理的には、それらは金属的で可鍛性の両方です。
ポスト遷移金属
ポスト遷移金属は、遷移金属とメタロイドの間に位置しています。標準温度では、それらは物質の固体状態にあります。それらは、高密度と高い導電率を持つ傾向があります。物理的には可鍛性と延性があります。
メタロイド
半金属は、金属と非金属の両方の特性を示します。たとえば、金属は良導体であり、非金属は不良導体です。これは、半金属が半導体であることを意味します (高温でのみ電気を伝導します)。また、それらは金属よりも脆いですが、非金属よりも脆くありません。物理的には光沢があったり鈍かったりすることがあり、通常は延性があり可鍛性があります。
ハロゲン (グループ 17)
ハロゲンという名前は、ギリシャ語で「塩形成剤」を意味します。これは、ハロゲンが金属と相互作用してさまざまな塩を形成することから明らかです。別の注意として、ハロゲンは元素のユニークなグループです。それらは、標準温度で物質の 3 つの状態にある元素を含む唯一の周期族です。 6 つのハロゲンがあり、17 族に属します。これらの元素には、フッ素 (F)、塩素 (Cl)、臭素 (Br)、ヨウ素 (I)、およびアスタチン (At) が含まれます。それらは反応性が高く、電気陰性度が高く、毒性の高い非金属です。
貴金属
貴金属は、ルテニウム (Ru)、オスミウム (Os)、ロジウム (Rh)、イリジウム (Ir)、Pd、プラチナ (Pt)、金 (Au)、銀 (Ag) で構成されます。希ガスと同様に、原子価殻が完全であるため不活性です。さらに、貴金属には触媒作用があります。また、腐食、変色、酸化に対して非常に耐性があります。最後に、他の多くの金属と同様に、柔らかく延性があります。
希ガス (グループ 18)
エアロゲンとも呼ばれる希ガスは不活性ガスです。例としては、アルゴン、クリプトン、ネオンなどがあります。それらは、周期表のグループ18にあります。同様に、これは完全な原子価殻を持つことを意味します。このため、それらは安定しており、比較的非反応性です。さらに、希ガスは低沸点、低融点である。物理的には無色で無臭です。
クールな要素を見る
ファミリ プロパティの概要表
| ファミリータイプ | プロパティ |
| アルカリ金属 | – 反応性が高い – 水に弱い - 柔らかい – 低密度 – 低融点 – 低沸点 |
| アルカリ土類金属 | – 強力な還元剤 – 銀色の光沢のある金属 – 良導体 – 低密度 – 低融点 – 低沸点 |
| 遷移金属 | – 2 つ以上の酸化状態 – 通常、常磁性化合物を形成する – 低イオン化エネルギー – 高融点 – 高沸点 – 高導電率 – メタリック – 順応性 |
| ポスト遷移金属 | – 標準温度で固体 – 可鍛性 – 延性 – 高導電率 – 高密度 |
| メタロイド | – 半導体 (高温でのみ伝導) – 金属よりも脆いが、非金属よりも脆くない – 特性は金属と非金属の混合物です – 光沢があるか鈍い – 延性と可鍛性 |
| ランタニド | – 5d 殻の 1 つの価電子 – 反応性が高い – 強力な還元剤 – 銀色の明るい金属 – 比較的柔らかい – 高融点 – 高沸点 |
| アクチニド | – 反応性が高い – 高い陽性率 – 常磁性 – パイロモーフィック – 同素体 – 放射性 – 銀色の金属 – 延性 – 可鍛性 – ソフト |
| ハロゲン | – 反応性が高い – 高い電気陰性度 – 非金属 – 有毒 |
| 貴金属 | – 比較的無反応 – 完全な原子価殻 (8 個の価電子) – 不活性 – 触媒 – 腐食、変色、酸化に対する耐性 – ソフトで延性 |
| 希ガス | – 比較的無反応 – 完全な原子価殻 (8 個の価電子) – 低電気陰性度 – 無色無臭 – 標準条件下のガス – 非金属 – 低沸点 – 低融点 – 下に行くほど密度が高くなる |
クールな化学実験を見る
さらに読む
原子の構造
定期的なトレンドが簡単に!