コア コンセプト
このチュートリアルでは、分子が求電子剤として機能するかどうかを判断する方法を学びます。これは、反応能力に影響を与える可能性のある求電子剤の構造に関する概念を理解することによって行われます。さらに、求電子試薬のリストを学習します。
他の記事で取り上げるトピック
- 求核剤
- 求電子芳香族置換
- 陽イオンと陰イオン
- イオン結合と共有結合
- 共鳴構造
語彙
- 陽イオン - 正に帯電したイオン
- 共有結合 - 2 つの非金属間または金属と半金属間の電子の共有
- 電子 - 原子核の外側にある負に帯電した亜原子粒子
- エレクトロン シンク - 分子上の電子不足部位
- 求電子性 - 化合物が求電子剤として作用する能力
- 脱離基 - 分子から離れることのできる原子または基
- 共鳴構造 - 電子が分子内を移動するさまざまな方法で、潜在的な反応のためにさまざまな電荷と場所を作成します
- 立体障害 - 分子の物理的サイズと構造がその反応性に与える影響
求電子試薬の紹介
求電子剤は、電子が豊富な分子である求核剤から電子を受け取ることによって共有結合を形成できる電子の少ない分子です。有機反応では、多くの分子が求電子剤として機能しますが、分子が求電子剤になる特定の方法があります。求電子試薬の詳細については、以下をご覧ください!
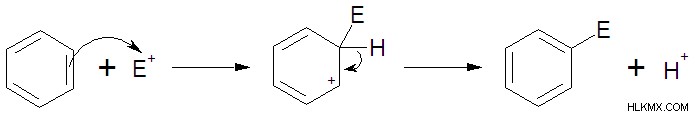
優れた求電子剤を構成する要因は何ですか?
チャージ
分子が求電子剤として作用する可能性は、電子シンクとなり、負電荷を受け入れる能力に依存します。分子は電子源への結合を受け入れるために電子を欠いている必要があるため、正の分子が最良の求電子試薬になります。
中性分子は、共鳴によって優れた求電子剤になることもあります。共鳴構造が存在する可能性がある場合、結合部位に電子シンクが存在する可能性が最も高く、電子を受け入れて結合を形成することができます。さらに、中性分子では、適切な脱離基がある場合、それを除去すると軌道が空になり、正電荷が発生する可能性があります。
一方、陰イオンは電子源であるため、より多くの電子を受け入れることができず、適切な求電子剤にはなりません.
絆の種類
良好な求電子剤は通常、弱い極性結合または分極性結合を含んでいます。これは、電子が結合の一方の側をもう一方の側よりも優先し、双極子を作成できることを意味します。これらの結合には、一方の側に部分的な正電荷 (通常は炭化水素分子の炭素) が含まれ、もう一方の側には部分的な負電荷 (通常は酸素などの電気陰性度の高い化合物) が含まれます。結合の部分的な正側はより求電子的になります.
立体障害
潜在的な結合部位が密集しているほど、他の分子がその電子を共有して共有結合を形成できる可能性が低くなります。これは立体障害として知られ、求電子部位に隣接する水素以外の分子への結合の数が増加するにつれて増加します。これにより、実行できる反応の種類が制限される可能性があります。したがって、分子の立体障害が少ないほど、さまざまな反応を起こしやすくなります。
反応制限の詳細については、こちらをお読みください!
求電子試薬のリスト
- 水素イオン-H
- ヒドロニウムイオン - H3 ああ
- 酸クロリド - CH3 COCl
- 二酸化炭素 – CO2
- 二原子ハロゲン - Br2 、私2 , F2
- ハロゲン化アルキル - CH3 CH2 Br
さらに読む
- イオン双極子力
- 極性結合と非極性結合
- 原子の構造







