塩は、酸と塩基の間の中和反応によって形成される化合物です。それらは一般に水中でイオン化し、陽イオンと陰イオンを生成します。塩のイオン化中に形成された陽イオンまたは陰イオンは、水溶液中で水和イオンとして存在するか、水と相互作用して酸と塩基を再生します。陽イオンまたは陰イオンと水との間の塩の相互作用のプロセスは、塩の加水分解として知られています。加水分解に基づいて、塩は 3 つのカテゴリに分類されます。
酸性塩
塩基性塩
中性塩
加水分解に基づく塩の種類
強酸と強塩基の塩:強酸と強塩基の中和によって形成される塩は、結合が塩溶液中で切断されないため、本質的に中性です。それらは通常水和していますが、加水分解しません。したがって、そのような塩は一般に中性塩として知られています。例:NaCl
NaCl は水中で解離して Na + イオンと Cl– イオンを形成します。
これらのイオンが水と反応すると、生成物は NaOH と HCl になります。これらは強力な電解質であり、完全にイオン化されています。 H + と
その後、OH-イオンが再結合して解離していない水分子を形成します。ニュートラルです。
弱酸と強塩基の塩:弱酸と強塩基の中和によって形成される塩は、基本的に塩基性です。たとえば、CH3COONa
CH3COONa → CH3COO– + Na+
CH3COO– + H2O ↔ CH3COOH + OH –
∴ [OH–]> [H+ ] したがって、ソリューションは本質的に基本的なものです
酢酸は弱酸で、溶液中で結合したままではありません。これにより、OH-イオンの濃度が増加し、溶液がアルカリ性になります。溶液の pH が 7 を超えています。
強酸と弱塩基の塩:強酸と弱塩基の中和によって形成される塩は、本質的に酸性です。例:NH4Cl
NH4Cl の加水分解は次のように表すことができます:
NH4Cl + H2O ↔ NH4OH + HCl
または NH4+ + Cl– + H2O ↔ NH4OH + H+ + Cl–
H+イオンを生成するため、そのような塩の溶液は酸性です。
水酸化アンモニウムは弱塩基で、溶液中に均一に留まります。これにより、H + イオンの濃度が増加し、溶液が酸性になります。このような溶液の pH は 7 未満です。
弱酸と弱塩基の塩:弱酸と弱塩基の中和によって形成される塩は、酸の性質に応じて、酸性、塩基性、または中性になります。そして関係する基地。例:CH3COONH4
理由は中立です
CH3COONH4 → CH3COO– + NH4+
CH3COO– + H2O ↔ CH3COOH + OH –
NH4+ + H2O ↔ NH4OH + H+
両方の反応が同じ速度で起こるため、解決策は本質的に中立です。
塩の加水分解式
塩は、酸と塩基が互いに中和するときに形成されるイオン化合物です。生理食塩水は常に中性に見えますが、多くの場合、酸性または塩基性です。
弱酸性のフッ化水素酸を強塩基の水酸化ナトリウムで中和したときに形成される塩を考えてみましょう。分子式と正味のイオン式を以下に示します。
HF (aq) + NaOH(aq) → NaF(aq) +H2O(l)
HF (aq) + OH–(aq) → F–(aq) +H2O(l)
フッ化ナトリウムは可溶性であるため、中和反応の傍観者イオンです。フッ化物イオンは、プロトンを受け入れることで水とわずかに反応します。
F–(aq) + H2O(l) ↔ HF (aq) + OH–(aq)
フッ化物イオンは弱いブレンステッド-ローリー塩基として作用します。上記の反応の結果として生成された水酸化物イオンは、溶液をわずかに塩基性にします。塩の加水分解は、塩のイオンの 1 つが水と反応して酸性または塩基性の溶液を形成する反応です。
基本溶液を形成する塩
固体のフッ化ナトリウムが水に溶解すると、ナトリウムイオンとフッ化物イオンに完全に解離します。ナトリウム イオンは加水分解できませんが、フッ化物イオンは加水分解して、少量のフッ化水素酸と水酸化物イオンを生成します。
F–(aq) + H2O(l) ↔ HF (aq) + OH–(aq)
弱酸 (HF) を強塩基 (NaOH) で中和して得られる塩は、常に塩基性塩溶液を生成します。
酸性溶液を形成する塩
塩化アンモニウム (NH4Cl) は、強酸 HCl が弱塩基 NH3 によって中和されるときに形成される塩です。塩化アンモニウムは水溶性です。生成された塩化物イオンは、強酸 HCl の共役塩基であり、加水分解できません。言い換えれば、Cl- イオンは、前のセクションのフッ化物イオンのように、水からプロトンを受け取って HCl と OH- を形成することはできません。ただし、アンモニウム イオンは水と容易に反応してプロトンを供与できるため、酸として作用します。
NH4+(aq) + H2O(l) ↔ H3O+ + NH3(aq)
天然溶液を形成する塩
強酸と強塩基の反応から生じる塩は、pH 7 で溶液を形成します。例として、HCl を NaOH で中和して生じる塩化ナトリウムがあります。 NaCl 両方のイオンが加水分解されないため、水溶液は酸性でも塩基性でもありません。中性溶液を形成するその他の塩には、硝酸カリウム (KNO3) や臭化リチウム (LiBr) などがあります。
加水分解反応は陽イオンと陰イオンの間で競合するため、弱酸と弱塩基の反応から形成される塩は分析がより困難です。
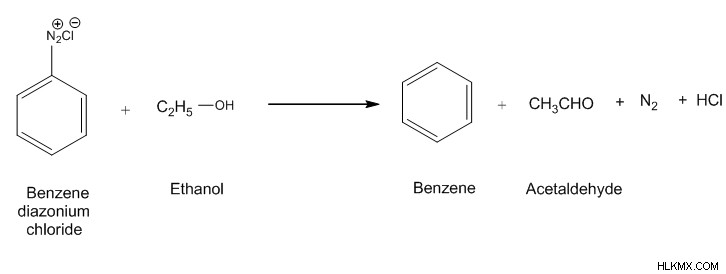
塩化ベンゼンジアゾニウムの加水分解
塩化ベンゼンジアゾニウムが加水分解されると、窒素分子が窒素ガスとして放出されます。水中の OH 基は、窒素ガスの除去後に残る空孔を攻撃します。これにより、フェノールが形成されます。
結論
塩は陽イオンと陰イオンで構成されるイオン化合物で、それぞれが水と酸または塩基のイオン化反応を引き起こします。したがって、塩の構成イオンの相対的な酸塩基強度に応じて、塩水溶液は酸性、塩基性、または中性であり得る。純水は弱電解質です。水素と水酸化物に完全に解離するわけではありませんが、これら2つのイオンと平衡状態にあるため弱いです。基本的に中立です。 H+ イオン濃度は OH イオン濃度とまったく同じです。いずれかのイオンの濃度を下げることによってこの状態が乱されると、中性の性質が酸性または塩基性に変化します。 [H+]> [OH] の場合、水は酸性になります。 [OH]、水は塩基性になります。これはまさに、塩の加水分解として知られる現象の間に起こる変化です。これは、塩の陽イオンおよび/または陰イオンが水と反応して酸またはアルカリ性を生成する反応として定義されます.







