極性は共有分子で発生します。共有結合は、同じ元素または異なる元素の 2 つの原子が電子を共有し、各原子がその希ガス電子配置を達成するときに形成されます。これらの共有分子は、極性または非極性のいずれかです。
この記事では、
1. 極性とは
2. 分子形状は極性にどのように影響するか
3.例
極性とは
分子の極性は、融点、沸点、表面張力、蒸気圧などの他の物理的特性を定義します。簡単に言えば、極性は、分子内の電子分布が分子は非対称です。これにより、分子内に正味の双極子モーメントが生じます。分子の一方の端は負に帯電し、もう一方の端は正に帯電します。
分子の極性の主な理由は、共有結合に関与する 2 つの原子の電気陰性度です。共有結合では、2 つの原子が一緒になって 1 対の電子を共有します。共有電子対は両方の原子に属します。ただし、電子に対する原子の引力は、元素ごとに異なります。たとえば、酸素は水素よりも電子に対してより多くの引力を示します。これは電気陰性度と呼ばれます。
結合の形成に関与する 2 つの原子の電気陰性度の差が 0.4<である場合、それらが共有する電子対は電気陰性度の高い原子に向かって引き寄せられます。これにより、電気陰性度の高い原子にわずかに負の電荷が生じ、もう一方にはわずかに正の電荷が残ります。このような場合、分子は分極していると見なされます。
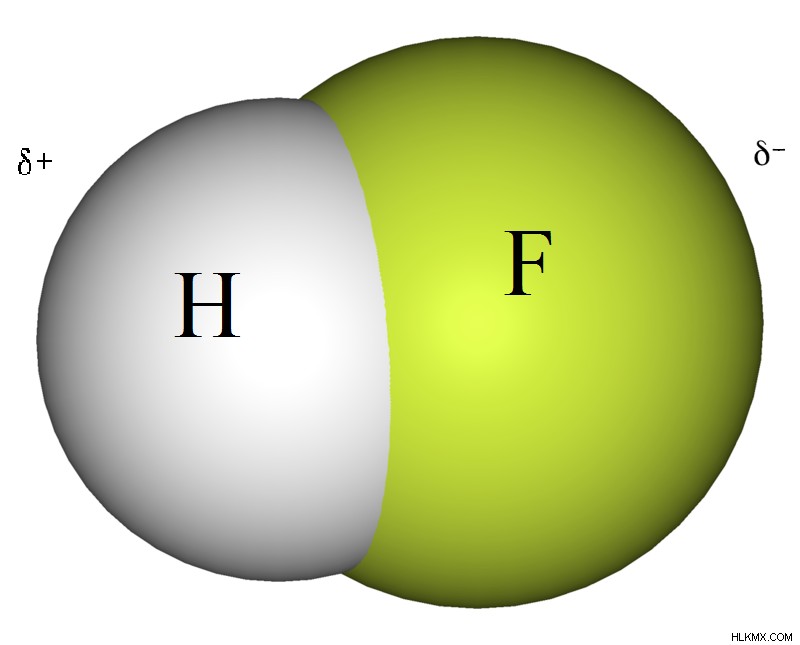
図 1:フッ化水素分子
HF 分子の非常に負の F はわずかに負に帯電し、H 原子はわずかに正になります。これにより、分子内の正味の双極子モーメントが生じます。
分子形状が極性に与える影響
分子の分極は、分子の形状に大きく依存します。上記の HF のような二原子分子には、形状の問題はありません。正味の双極子モーメントは、2 つの原子間の電子の不均一な分布のみが原因です。ただし、結合の形成に 3 つ以上の原子が関与している場合は、多くの複雑さが生じます。
例として、極性の高い水分子を見てみましょう。
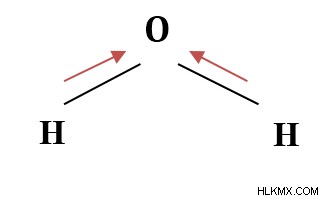
図 2:水分子
水の分子は曲がった形をしています。したがって、2 つの水素原子を持つ酸素によって共有される 2 つの電子対が酸素に向かって引っ張られると、正味の双極子モーメントは酸素原子の方向になります。結果として生じる双極子モーメントを相殺する他の力はありません。したがって、水分子は非常に極性があります。
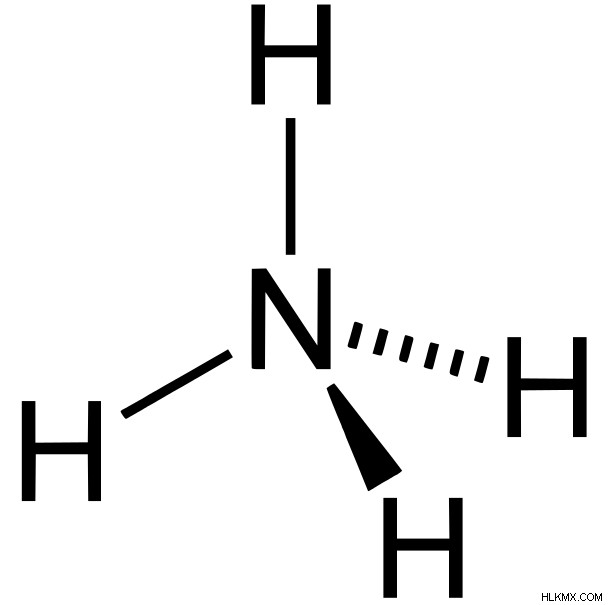
図 3:アンモニア分子
アンモニア分子はピラミッド型で、電気陰性度の N 原子が電子を自分自身に引き寄せます。 3 つの N-H 結合は同じ平面上にありません。したがって、作成された双極子モーメントは相殺されません。これにより、アンモニアは極性分子になります。
ただし、分子の形状によって双極子モーメントが打ち消され、分子が無極性になることがあります。二酸化炭素はそのような分子です。
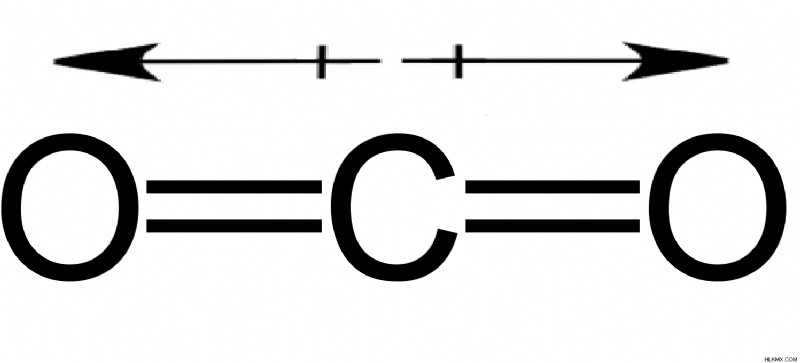
図 4:二酸化炭素分子
C 原子と O 原子の電気陰性度の差は 1.11 で、電子は O 原子に偏ります。しかし、二酸化炭素分子は平面線形です。 3 つの原子はすべて同じ平面上にあり、C は 2 つの O 原子の真ん中にあります。 1 つの C-O 結合の双極子モーメントは、2 つの反対方向にあるため、もう一方を相殺して、二酸化炭素分子を非極性にします。電気陰性度の違いは十分でしたが、形状は分子の極性を決定する上で重要な役割を果たします.
四塩化炭素の極性も同様のシナリオです。
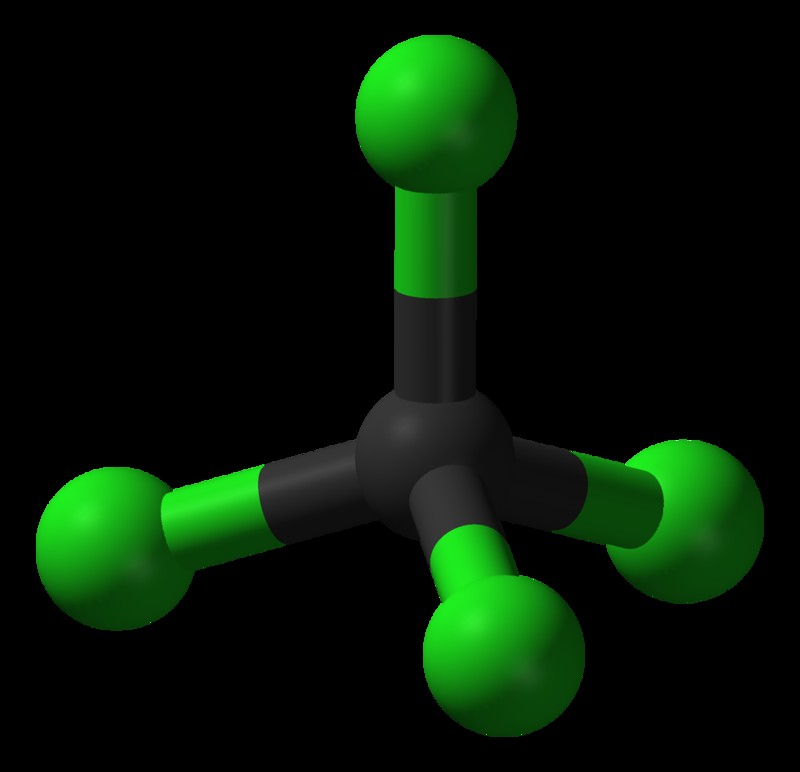
図 5:四塩化炭素分子
炭素と塩素の電気陰性度の差は、C-Cl 結合が分極するのに十分です。 C と Cl の間で共有される電子のペアは、より Cl 原子に向かっています。ただし、四塩化炭素分子は対称的な四面体の形状であるため、結合の正味の双極子モーメントが相殺され、正味の双極子モーメントがゼロになります。したがって、分子は無極性になります。