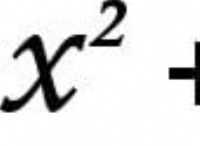内側のシェルは、核への近接性に従ってラベル付けされ、最も内側のシェルはKシェルとして指定され、その後はL、M、Nなどが続きます。各シェルは、量子力学の原理に基づいて、特定の数の電子を保持できます。
* kシェル: これは最も内側のシェルであり、最大2つの電子を保持できます。
* lシェル: Lシェルは2番目のエネルギーレベルであり、最大8つの電子(2Sおよび2Pサブシェル)を収容できます。
* Mシェル: Mシェルは3番目のエネルギーレベルであり、最大18電子(3S、3P、および3Dサブシェル)を保持できます。
* nシェル: Nシェルは4番目のエネルギーレベルであり、最大32電子(4S、4P、4D、および4Fサブシェル)を収容できます。
内側のシェル電子は、一般に、外殻電子よりも核にしっかりと結合しています。これは、彼らがより高い正電荷のために核からのより強い静電力の力を経験するためです。電子が核に近いほど、エネルギーが低くなり、より強く保持されます。
内側のシェル電子の配置と挙動は、さまざまな原子特性とプロセスにおいて重要な役割を果たします。それらは、元素の全体的な電子構成に寄与し、その化学的結合挙動、原子サイズ、イオン化エネルギー、およびその他の基本特性に影響を与えます。