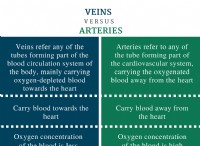
1。アンモニウムイオン構造:
*アンモニウムイオンには、4つの水素原子に結合した正に帯電した窒素原子があります。
*この正電荷は、共鳴のためにイオン全体に広がっています。
2。水との反応:
*アンモニウムイオンが水に溶解すると、水分子と相互作用できます。
*アンモニウム中の正に帯電した窒素は、水の酸素原子に孤立した電子のペアを引き付けます。
*この相互作用は、水分子のO-H結合を弱めます。
*弱体化した結合により、水素イオン(H⁺)を水分子に寄付することができます。
nh₄⁺ +h₂o
3。ハイドロニウムイオンの形成:
*プロトンを獲得する水分子は、水中の酸性度を定義する特徴的な種であるハイドロニウムイオン(H₃O⁺)になります。
*アンモニウムイオンは、酸として作用する陽子を寄付します。
4。平衡:
*アンモニウムと水の間の反応は平衡反応です。
*アンモニウムは陽子を水に寄付しますが、逆反応も発生し、ハイドロニウムイオンは陽子をアンモニア(NH₃)に供給できます。
*ただし、平衡はわずかに右にあります。つまり、平衡状態でより多くのヒドロニウムイオンとアンモニアが存在することを意味します。
5。 pH効果:
*溶液中のヒドロニウムイオンの存在はpHを低下させ、溶液を酸性にします。
要約すると、アンモニウムは水に水に酸性です。なぜなら、それは水に陽子を寄付し、ハイドロニウム・イオン(h₃o⁺)を形成し、溶液の酸性度を高めることができるためです。