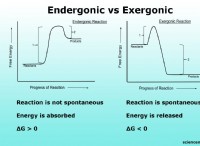
この規則は、原子が希ガスの電子構成と同様に、最も外側のシェルに8つの電子(価電子シェル)に8つの電子がある場合に最も安定していると述べています。
これがどのように機能するかです:
* 電子の獲得: 非金属は、完全なオクテットを達成するために電子を獲得する傾向があり、負に帯電したイオン(アニオン)を形成します。
* 紛失電子: 金属は完全なオクテットを達成するために電子を失う傾向があり、積極的に帯電したイオン(陽イオン)を形成します。
* 電子の共有: 原子は他の原子と電子を共有して完全なオクテットを実現し、共有結合を形成します。
Octetルールは有用なガイドラインですが、普遍的に適用可能ではありません。 たとえば、水素とヘリウムは安定性を実現するために2つの電子を必要とするだけです。 さらに、より大きな原子は、原子価の8つ以上の電子を収容できます。