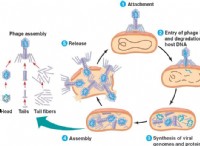
1。サイズと軌道オーバーラップ:
* リン(P)は窒素(n)よりも大きい。 これは、リンの3D軌道がより拡散し、塩素原子の2p軌道とより良く重複する可能性があることを意味します。
* 窒素の2p軌道は小さく、拡散が少ない。 これらの軌道と塩素の2p軌道の間の重複はそれほど効果的ではなく、結合が弱くなります。
2。電気陰性度:
* 窒素はリンよりも電気陰性です。 これは、窒素が電子を引き付ける傾向が高いことを意味します。 N-CL結合の電子上の窒素の強い引っ張りは、分子をより不安定で反応性にします。
3。拡張オクテット:
* リンは、その原子価殻の8つ以上の電子を収容できます。 これは、利用可能なd軌道があるためです。 pcl 5 5つの塩素原子が中央のリンに結合し、その原子価殻にリン10電子を与えます。
* 窒素はオクテットを拡張できません。 利用可能なD軌道がなく、その周りに8つ以上の電子を置こうとすると、Octetルールに違反します。
要約:
* pcl 5 リンは周囲の5つの塩素原子を収容するのに十分な大きさであり、良好な軌道オーバーラップのために強い結合を形成するため、安定しています。また、オクテットを拡張して、8つ以上の価電子を可能にします。
* ncl 5 窒素は5つの塩素原子には小さすぎて、軌道のオーバーラップと弱い結合につながるため、不安定です。さらに、窒素はオクテットを拡張できず、5つの塩素原子を備えた安定した構造を形成することは不可能です。
化学結合について他に質問がある場合はお知らせください!