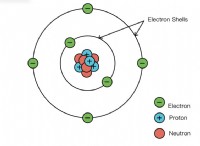
1。価電子と化学結合:
* オクテットルール: 原子は電子を獲得、失い、または共有する傾向があり、高貴なガスと同様に、8つの原子価電子で安定した構成を実現します。これはOctetルールとして知られています。
* イオン結合: 電気陰性度(電子を引き付ける傾向)に大きな違いがある原子は、イオン結合を形成する可能性があります。 1つの原子は電子を失います(積極的に帯電した陽イオンになります)が、もう1つの原子は電子(負に帯電した陰イオンになります)を獲得します。これらの反対に帯電したイオン間の静電魅力はそれらをまとめます。
* 共有結合: 類似した電気陰性度を持つ原子は、安定した構成を実現するために電子を共有します。この共有は、原子の間に電子が局在する共有結合を作成します。
* 金属結合: 金属では、価電子は非局在化し、格子全体で自由に移動できます。これにより、金属原子を一緒に保持する電子の「海」が作成されます。
2。化学結合と材料特性:
* 結合タイプと材料特性: 結合のタイプは、材料の物理的および化学的特性に大きく影響します。
* イオン化合物: 一般に、融点が高く、脆く、溶けたり溶けたりすると電気を伝達します。
* 共有化合物: 固体、液体、またはガスであり、さまざまな融点と電気伝導率があります。
* 金属化合物: 通常、熱と電気の良好な導体、順応性、および延性があります。
* 分子形状: 分子内の原子の配置(原子価電子の数とそれらの共有方法によって決定)は、その形状と特性に影響します。
* 極性: 分子は、極性(不均一な電子分布)または非極性(偶数分布)であり、他の分子との相互作用に影響を与えます。
* 分子間力: 水素結合、双極子双極子相互作用、ロンドン分散力などの分子間の魅力は、材料の融点、沸点、溶解度に影響します。
3。例:
* 塩化ナトリウム(NaCl): ナトリウム(Na)は、安定した構成を実現するために1つの電子を失い、Na+カチオンを形成します。塩素(Cl)は1つの電子を獲得してCl-陰イオンを形成します。これらのイオン間の静電引力は、イオン化合物の化合物ナトリウム塩化ナトリウムを形成します。これは、融点が高い固体であり、水に溶けます。
* 水(H2O): 酸素(O)は、各水素(H)原子と2つの電子を共有し、共有結合を形成します。得られた分子は、酸素原子の孤立ペアのために曲がった形をします。水は、分子間の強い水素結合により、比較的高い沸点を持つ液体です。
* 銅(Cu): 銅には、簡単に非局在する1つの価電子があり、金属結合を形成します。これにより、銅は熱と電気の優れた導体になることができ、順応性と延性があります。
要約:
原子内の外部電子の配置は、それが他の原子とどのように相互作用して結合を形成するかを決定し、最終的に材料の種類とその特性を決定します。価電子の構成を理解することは、自然に見られる材料の膨大な多様性と、特定のアプリケーションに適した特性を理解するための鍵です。