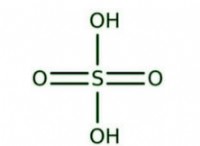
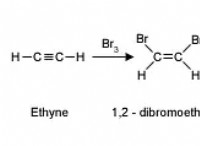
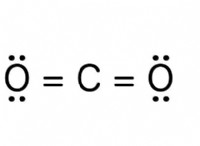* 強力な静電力: イオン化合物は、反対に帯電したイオン間の魅力の強い静電力によって結合されます。これらの力は、克服するためにかなりの量のエネルギーを必要とし、高い融点につながります。
* 結晶構造: イオン化合物は、イオンが密接に詰め込まれている高度に秩序化された結晶構造を形成します。この構造は、静電力の強度をさらに高めます。
融点に影響を与える要因:
* イオンの電荷: イオンのより高い電荷は、より強いアトラクションにつながり、したがって融点が高くなります。たとえば、酸化マグネシウム(MGO)は、それぞれMGおよびOイオンの+2および-2電荷により、塩化ナトリウム(NACL)よりも融点が高くなっています。
* イオンのサイズ: イオンが小さいため、近接性が近いため、静電力が強くなり、融点が高くなります。
* 偏光: 偏光が高いイオンは、より弱いアトラクションと融点が低くなる可能性があります。
融点が高いイオン化合物の例:
* 塩化ナトリウム(NaCl): 801°C(1474°F)
* 酸化マグネシウム(MGO): 2852°C(5166°F)
* 炭酸カルシウム(CACO3): 825°C(1517°F)
この一般的なルールには例外がある可能性があることに注意することが重要です。一部のイオン化合物は、複雑な構造や弱い相互作用などの要因により、融点が比較的低い場合があります。